由于氟原ååŠå¾‘å°ï¼Œä¸”å…·æœ‰æœ€å¼·çš„é›»è² æ€§(4.0),引入氟原ååŽå°C-Féµæ¥µæ€§æ–¹å‘和整個分åçš„é›»å云分布å‡æœƒç™¼ç”Ÿè®ŠåŒ–,影響分åçš„å¶æ¥µçŸ©ã€é…¸å ¿æ€§ç‰ï¼Œé€²è€Œå½±éŸ¿æ•´å€‹åˆ†å的物ç†æ€§è³ªå’ŒåŒ–å¸æ€§è³ªã€‚
氟原å或å«æ°ŸåŸºåœ˜çš„å¼•å…¥é€šå¸¸é‚„æœƒå¢žåŠ åˆ†å的脂溶性和ç–水性,æ高藥物分å的溶解度,促進藥物的傳導和å¸æ”¶ã€‚所以很多å«æ°Ÿè—¥ç‰©æˆ–者農藥相å°å…·æœ‰ç”¨é‡å°‘ã€æ¯’性低ã€è—¥æ•ˆé«˜ç‰ç‰¹é»žï¼Œé€™ä½¿å¾—å«æ°Ÿè—¥ç‰©æˆ–農藥所å 比例越來越高。
在å„種å«æ°Ÿç Œå¡Šä¸ï¼Œçƒ¯åŸºå«æ°Ÿç Œå¡Šæ˜¯éžå¸¸é‡è¦çš„生物活性分åçµæ§‹ï¼Œå…·æœ‰å„種藥ç†æ´»æ€§ï¼ˆå¦‚抗癌ã€æŠ—èŒã€æŠ—艾滋病毒ã€æŠ—糖尿病),還å¯ä»¥ä½œç‚ºåˆæˆç Œå¡Šç”¨äºŽåˆ¶å‚™ä¸åŒçš„å«æ°Ÿå®˜èƒ½åœ˜ã€‚
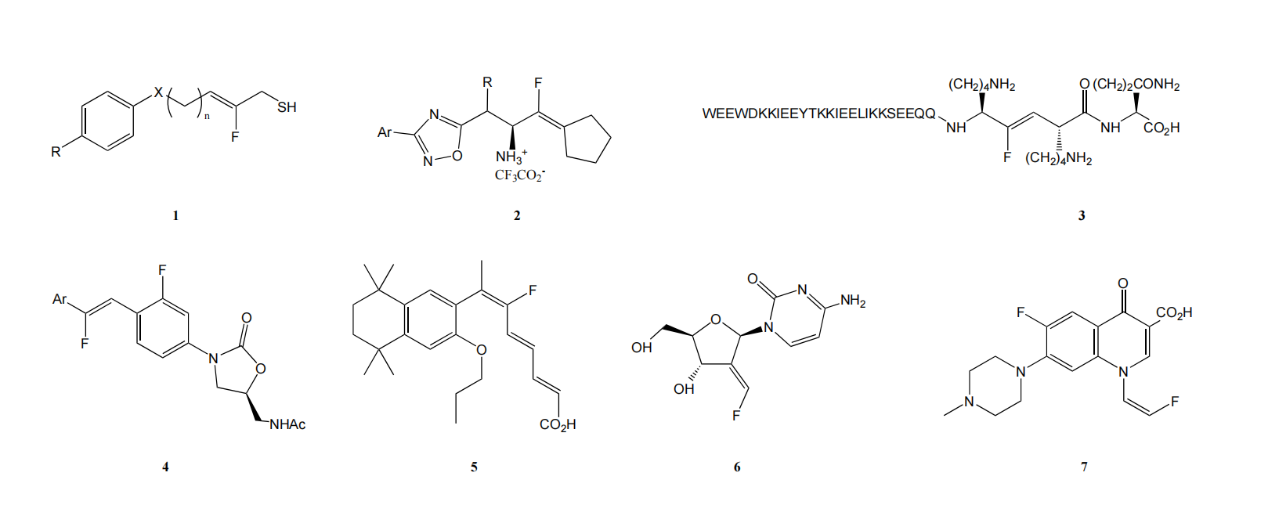
圖1. 具有生物活性的烯基å«æ°Ÿç Œå¡Š
1.HDAC抑制劑(histone deacetylase inhibitors)——抗癌
2.DPP-4抑制劑(Dipeptidyl peptidase 4 inhibitors)——抗2åž‹ç³–å°¿ç—…
3.HIVèžåˆæŠ‘制劑(HIV fusion inhibitor)——抗艾滋病毒藥物
4.蛋白åˆæˆæŠ‘制劑 (Protein synthesis inhibitors)——抗èŒè—¥ç‰©
5.視黃醇Xå—體調節劑(Retinoid X receptor regulator )——抗2åž‹ç³–å°¿ç—…
6.æ ¸ç³–æ ¸è‹·é…¸é‚„åŽŸé…¶æŠ‘åˆ¶åŠ‘(Ribonucleotide reductase inhibitor)——抗癌
7.DNA回旋酶抑制劑(DNA gyrase inhibitor)——抗èŒè—¥ç‰©
åˆæˆæ–¹æ³•
1. 烯化å應
2-æ°Ÿ-2-膦酰基乙酸三乙酯(Triethyl 2-fluoro-2-phosphonoacetate)å’Œæ°Ÿç”²åŸºè‹¯åŸºç œ(Fluoromethyl phenyl sulfone)æ˜¯æ¯”è¼ƒç¶“å…¸çš„å–®æ°Ÿç Œå¡Šã€‚
2-æ°Ÿ-2-膦酰基乙酸三乙酯通常由膦酰基乙酸三乙酯通éŽè¦ªé›»æ°ŸåŒ–試劑氟化åˆæˆï¼Œå…¶å¯ä»¥åœ¨å ¿ä½œç”¨ä¸‹èˆ‡é†›é…®åŒ–åˆç‰©ç¶“由膦葉立德ä¸é–“體制得α-æ°Ÿ-α,β-ä¸é£½å’Œç¾§é…¸é…¯ 。其ä¸ï¼Œé†›ç¾°åŸºå應活性高于酮羰基å應活性,åŒæ™‚é‚„å…·æœ‰æ›´å¥½çš„é †åé¸æ“‡æ€§ã€‚(方案1)
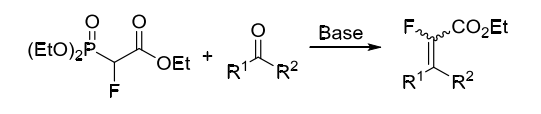
方案1. 2-æ°Ÿ-2-膦酰基乙酸三乙酯作為å«æ°Ÿç Œå¡Š
1994年,Patrickèª²é¡Œçµ„å ±é“甘油醛和2-æ°Ÿ-2-膦酰基乙酸三乙酯在ä¸åŸºé‹°ä½œç”¨ä¸‹Eå¼å–®ä¸€ç”¢ç‰©[1]。(方案2)
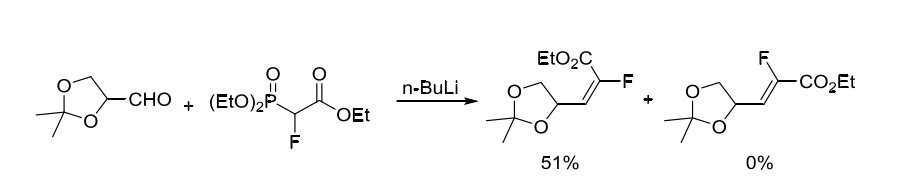
方案2. 2-æ°Ÿ-2-膦酰基乙酸三乙酯作為å«æ°Ÿç Œå¡Š
Gernert課題組也在2003年使用2-æ°Ÿ-2-膦酰基乙酸三乙酯與酮羰基化åˆç‰©å應åˆæˆæ°ŸåŒ–產物,但產物是ä¸å…·æœ‰é †åé¸æ“‡æ€§çš„[2]。(方案3)
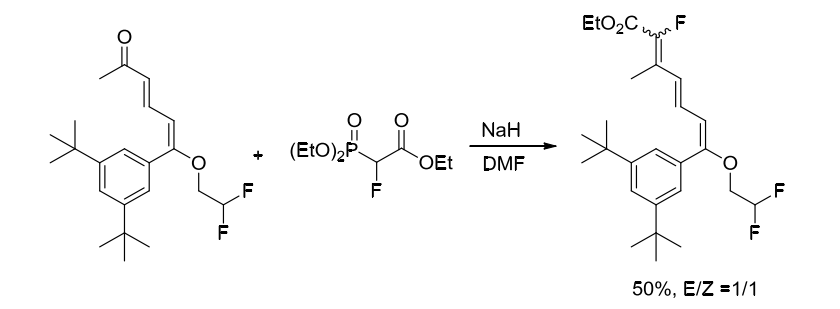
方案3. 使用å«æ°Ÿç Œå¡Š2-æ°Ÿ-2-膦酰基乙酸三乙酯åˆæˆæ°ŸåŒ–烯烴
上文æåˆ°çš„æ°Ÿç”²åŸºè‹¯åŸºç œè¿‘å¹´ä¾†ä¹Ÿè¢«ä½œç‚ºè¢«ç¶“å¸¸ä½¿ç”¨çš„å«æ°Ÿç Œå¡Šã€‚在1985年,McCarthy課題組早在1985å¹´ç ”ç©¶äº†å…¶åˆ¶å‚™æ–¹æ³•ï¼Œå應性質以åŠå應機ç†ã€‚æ°Ÿç”²åŸºè‹¯åŸºç œé¦–å…ˆæœƒèˆ‡ä¸åŸºé‹°å應生æˆæ°Ÿç”²åŸºè‹¯åŸºç œé‹°é¹½ä¸é–“體,然åŽç›´æŽ¥èˆ‡èŠ³é¦™é†›å應得到相應的α-æ°Ÿ-β-ç¾¥åŸºç œåŒ–åˆç‰©ã€‚該化åˆç‰©å†é€šéŽè„«åŽ»ç œåŸºä»¥å½¢æˆå–®æ°Ÿæœ«ç«¯çƒ¯çƒ´[3-5]。(方案4)
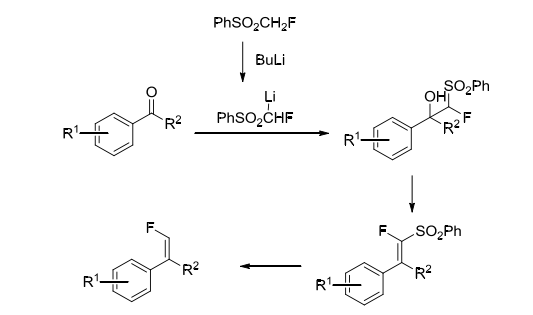
方案4. æ°Ÿç”²åŸºè‹¯åŸºç œä½œç‚ºå«æ°Ÿç Œå¡Š
2.消除å應
消除å應是制備α-å–代的α-氟烯烴的常用方法。為了將末端烯烴轉化為它們的氟化當é‡ï¼Œé¹µåŒ–å應和消除å應被廣泛使用
[6]。(方案5)。
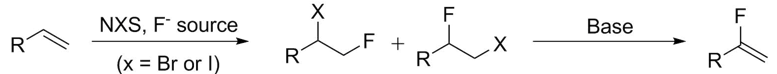
這種消除éŽç¨‹é€šå¸¸è¢«èªç‚ºæ˜¯SN2å應的競çˆéŽç¨‹ï¼Œç‰¹åˆ¥æ˜¯ç•¶å˜åœ¨å¼·å ¿æ™‚。它å¯ä»¥ç™¼ç”Ÿåœ¨ä¸€ç´šã€äºŒç´šå’Œä¸‰ç´šåº•ç‰©ä¸Šã€‚除éžä½¿ç”¨ç‰¹æ®Šçš„éžè¦ªæ ¸èƒºå ¿ï¼Œå¦å‰‡å¼·å ¿å˜åœ¨ä¸‹çš„åˆç´šåº•ç‰©é€šå¸¸åªæœƒç”¢ç”Ÿå–代。
ç”¨å…·æœ‰å¼·å ¿å’Œèƒºå ¿çš„äºŒç´šå’Œä¸‰ç´šåº•ç‰©å¾ˆå®¹æ˜“æ¶ˆé™¤ã€‚æ¶ˆé™¤æ˜¯äºŒç´šçš„ï¼Œå–æ±ºäºŽåº•ç‰©å’Œå ¿æ¿ƒåº¦ã€‚å ¿éœ€è¦åœ¨ä¸€æ¥éŽç¨‹ä¸æ”»æ“Šβ-氫。
大多數E2å應æä¾›å–代最多的烯烴作為主è¦ç•°æ§‹é«”,但å¯èƒ½ä½¿ç”¨çš„æ¢ä»¶æœƒæ”¹è®Šå€åŸŸé¸æ“‡æ€§ã€‚å½¢æˆæ›´å¤šå–代的烯烴稱為Saytzeff消除。å應的å€åŸŸé¸æ“‡æ€§å—å ¿çš„æ€§è³ªå½±éŸ¿å¾ˆå¤§ã€‚å¤§çš„å”ä¸é†‡å ¿å¤ªå¤§è€Œä¸èƒ½æ”»æ“Šå…§éƒ¨CH2基團,從而攻擊CH3基團。甲醇比å”ä¸é†‡æ›´å°ï¼Œå°CH2基團的攻擊更大,但主è¦ç”¢ç‰©ä»ç„¶æ˜¯1-烯烴。
幾乎所有的消除å應都產生烯烴混åˆç‰©ï¼Œè€Œä¸æ˜¯ä¸€ç¨®æ¸…潔的產物。å應由產物的穩定性(和éŽæ¸¡æ…‹ï¼‰æ±ºå®šï¼Œå› æ¤çƒ¯çƒ´çš„穩定性差異很å°ã€‚å–代度高的烯烴比å–代度低的烯烴更穩定,但能é‡å·®å¾ˆå°ã€‚
æ¤å¤–,當Eå’ŒZ烯烴異構體å¯èƒ½å˜åœ¨æ™‚,主è¦ç•°æ§‹é«”是E異構體,但Z異構體通常å˜åœ¨ä¸€å®šç¨‹åº¦ã€‚
3.交å‰å¶è¯å應
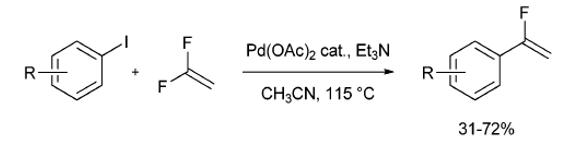
在金屬催化交å‰å¶è¯é ˜åŸŸï¼ŒHeckå應是烯烴芳基化的一種éžå¸¸æ–¹ä¾¿çš„方法。在大多數情æ³ä¸‹ï¼Œä¹™çƒ¯åŸºçš„氫原å被有機鹵化物的有機殘基å–代。當使用ä¸å°ç¨±å–代的烯烴時,由于空間ä½é˜»æ±ºå®šçš„高å€åŸŸé¸æ“‡æ€§ï¼Œå°Žè‡´åœ¨è¼ƒå°‘å–代ä½é»žç™¼ç”Ÿçƒ¯çƒ´èŠ³åŸºåŒ–。å應的關éµæ¥é©Ÿä¹‹ä¸€æ˜¯β-氫化物消除。
1991年,Heitzå’ŒKnebelkamp試圖從芳基碘化物和å二氟乙烯åˆæˆβ,β-二氟苯乙烯。在乙酸鈀催化作用下,如果β-氫化物消除是必è¦çš„å應æ¥é©Ÿï¼Œβ,β-二氟苯乙烯應該是唯一的å應產物。而β,β二氟苯乙烯在這些å應ä¸åƒ…作為副產物形æˆã€‚第一次發ç¾äº†åœ¨Pd(OAc)2催化æ¢ä»¶ä¸‹ä½¿èŠ³åŸºç¢˜åŒ–物與1,1-二氟乙烯å應來ç²å¾—α-氟乙烯è¡ç”Ÿç‰©çš„一æ¥å應[7]。(方案6)
4.親電氟化
Pachecoå’ŒGouverneurç ”ç©¶äº†çƒ¯ä¸™åŸºç”²åŸºç¡…çƒ·åœ¨Selectfluorså應æ¢ä»¶ä¸‹çš„å應性,以便在ä¸ä½¿ç”¨æ°ŸåŒ–構建塊的情æ³ä¸‹é€²è¡Œè¦ªé›»æ°Ÿè„«ç¡…å應制備氟二烯怕[8]。(方案7)
å…¶ä¸ï¼ŒSelectfluor氟化試劑(N-æ°Ÿ-N'-(氯甲基)三乙二胺雙(四氟硼酸鹽)或F-TEDA)是一種用戶å‹å¥½æ€§çš„ã€æº«å’Œçš„ã€åœ¨ç©ºæ°£å’Œæ°´åˆ†ç‹€æ³ä¸‹ç©©å®šçš„ã€éžæ®ç™¼æ€§çš„親電氟化å應劑。Selectfluoræ°ŸåŒ–è©¦åŠ‘èƒ½å¤ åœ¨ä¸€å€‹æ¥é©Ÿå…§å°‡æ°Ÿå¼•å…¥æœ‰æ©Ÿåº•ç‰©ï¼Œå…·æœ‰éžå¸¸å»£æ³›çš„å應范åœ[9]。這些å應ä¸ï¼Œçµ•å¤§å¤šæ•¸éƒ½è¡¨ç¾å‡ºäº†å„ªç•°çš„å€åŸŸé¸æ“‡æ€§ã€‚
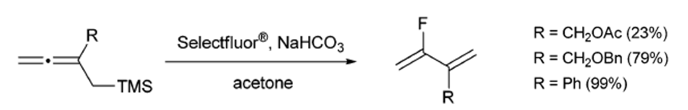
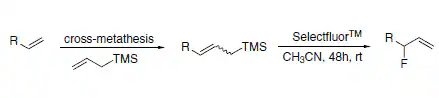
烯丙基氟化物å¯ä»¥é€šéŽäº¤å‰å¾©åˆ†è§£å應/親電氟脫硅路線制備(方案8)。這種途徑é¿å…了使用DASTé€²è¡Œè¦ªæ ¸ç½®æ›æˆ–é–‹ç’°å應時烯丙基轉ä½ç”¢ç”Ÿçš„副產物的形æˆ[10]。
應用
ç›®å‰å«æ°Ÿç Œå¡Šå·²ç¶“在醫藥ã€è¾²è—¥ã€æŸ“æ–™ã€è¡¨é¢æ´»æ€§åŠ‘ã€æ°Ÿç¢³ææ–™ã€èˆªç©ºèˆªå¤©ç‰å„ç¨®åŒ–å·¥é ˜åŸŸå¾—åˆ°å»£æ³›æ‡‰ç”¨ã€‚
å…¶ä¸ï¼Œçƒ¯åŸºå«æ°Ÿç Œå¡Šåœ¨æ料科å¸å’Œåˆæˆæœ‰æ©ŸåŒ–å¸ä¸å…·æœ‰æ½›åœ¨çš„應用,å¯ä»¥ç”¨ä½œæ°ŸåŒ–åˆæˆå進行進一æ¥çš„功能化。æ¤å¤–,氟化烯基å¯ä»¥ä½œç‚ºè‚½éµåŒå·¥é…¶ç”¨äºŽè—¥ç‰©åŒ–å¸ï¼Œé€™ç‚ºå°‹æ‰¾æ–°çš„生物活性化åˆç‰©é–‹è¾Ÿäº†æ–°çš„機會。
åƒè€ƒæ–‡ç»
1.Patrick, T. B.; Lanahan, M. V.; Yang, C.; Walker, J. K.; Hutchinson, C. L.; Neal, B. E., J. Org. Chem.1994,59, 1210.
2. Gernert, D. L.; Ajamie, R.; Ardecky, R. A.; Bell, M. G.; Leibowitz, M. D.; Mais, D. A.; Mapes, C. M.; Michellys, P. Y.; Rungta, D.; Reifel-Miller, A.; Tyhonas, J. S.; Yumibe, N.; Grese, T. A., Bioorg. Med.
Chem. Lett.2003,13, 3191.
3. McCarthy, J. R.; Peet, N. P.; LeTourneau, M. E.; Inbasekaran, M., J. Am. Chem. Soc.1985,107, 735.
4. McCarthy, J. R.; Peet, N. P.; LeTourneau, M. E.; Inbasekaran, M., J. Am. Chem. Soc.1985,107, 735.
5. McCarthy, J. R.; Huber, E. W.; Le, T.-B.; Mark Laskovics, F.; Matthews, D. P., Tetrahedron 1996,52, 45.
6. Takeuchi Yoshio,Yamada Asuka,Suzuki Takanori,Koizumi Toru. Synthetic studies towards proline amide isosteres, potentially useful molecules for biological investigations[J]. Tetrahedron,1996,52(1).
7. Walter Heitz,Arno Knebelkamp. Synthesis of fluorostyrenes via palladiumâ€catalyzed reactions of aromatic halides with fluoroolefins[J]. Macromolecular Rapid Communications,1991,12(2).
8. Furuya Takeru,Ritter Tobias. Fluorination of boronic acids mediated by silver(I) triflate.[J]. Organic letters,2009,11(13).
9. Singh, R. P. , Shreeve, J. M.. 2004. For a review of recent highlights: Acc. Chem. Res..37, 31.
10. Thibaudeau S, Gouverneur V. 2003. Sequential Cross-Metathesis/Electrophilic Fluorodesilylation:? A Novel Entry to Functionalized Allylic Fluorides. Org. Lett.. 5(25):4891-4893.